水素を直接燃やして熱にしてエネルギーを得ることの他に、直接電気にすることもできます。
それが「燃料電池」です。
ちょっと難しいかもしれませんが、水素は電子を放出して水素イオンになることができます。
H2 → 2H+ (水素イオン) + 2e- (電子)
この電子は導線で取り出すことができ、例えば電球に明かりをともすことができます。
電球が輝き続けるには、電子の流れが続かなければなりません。
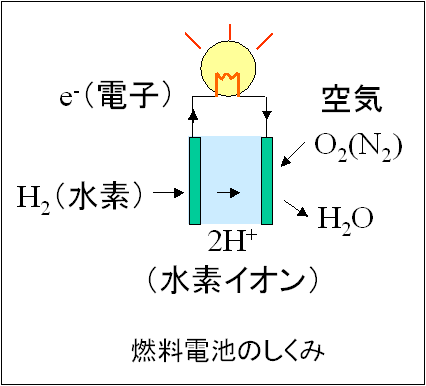
つまり、流れてくる電子を取り除く必要があります。
そのために、空気中の酸素を使います。
2H+ (水素イオン) + 1/2 O2 (酸素) + 2e- (電子) → H2O
最後は水となって電子を取り除きます。
こうして、電球はともり続けます。
この方式による発電効率は、80%位あり、現在の火力発電の2倍位大きいものです。
それが、燃料電池が注目される理由です。
少し難しい言葉ですが、化学エネルギーを直接電気エネルギーにすることで、効率よく変換が行われるのです。
石油をはじめとした化石資源は、燃やすことでエネルギーを発生します。
私たちは、これまで主にこのエネルギーを使い生活をしてきました。
しかし、化石資源には限りがあり、燃やす際に地球温暖化の原因となる二酸化炭素や有害なガス・化学物質が出ます。
そのためクリーンなエネルギーである水素が必要となっています。
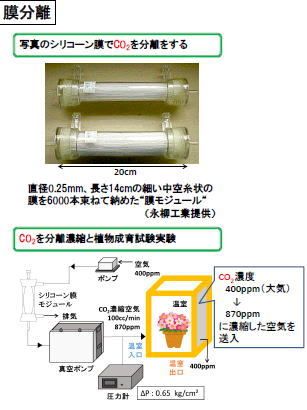
二酸化炭素の濃縮と植物成長実験
みなさんは、「燃料電池車」という言葉を聞いたことがありますか?
燃料電池車は、「水素エネルギー」で動く環境にやさしい未来の車です。
私たちの膜反応工学研究室では、今注目されている「水素エネルギー」をテーマに、環境にやさしい水素エネルギー社会を目指した研究を進めています。
ここでは、水素エネルギーについて説明していきます。
水素の特徴は以下の通りです。
1) 無色、無臭、無味、無毒のガス
2) 2個の水素原子から成る二原子分子で、最も軽い(0.0899g/cm3)
3)宇宙で最も多く存在する(重量で宇宙の90%を占める)
4) 酸素と反応して容易に水になる。
5) 空気中では4〜74%の濃度にある時燃える。
6) 炎は青白色で見えない。
7) 融点=-259.2℃、沸点=-252.8℃
8) 1766年イギリスのキャベンデッシュによって発見
生成するのは水だけです。CO2はもちろん、有害なガス・化学物質が出ないので、環境には大変やさしい熱源といえます。
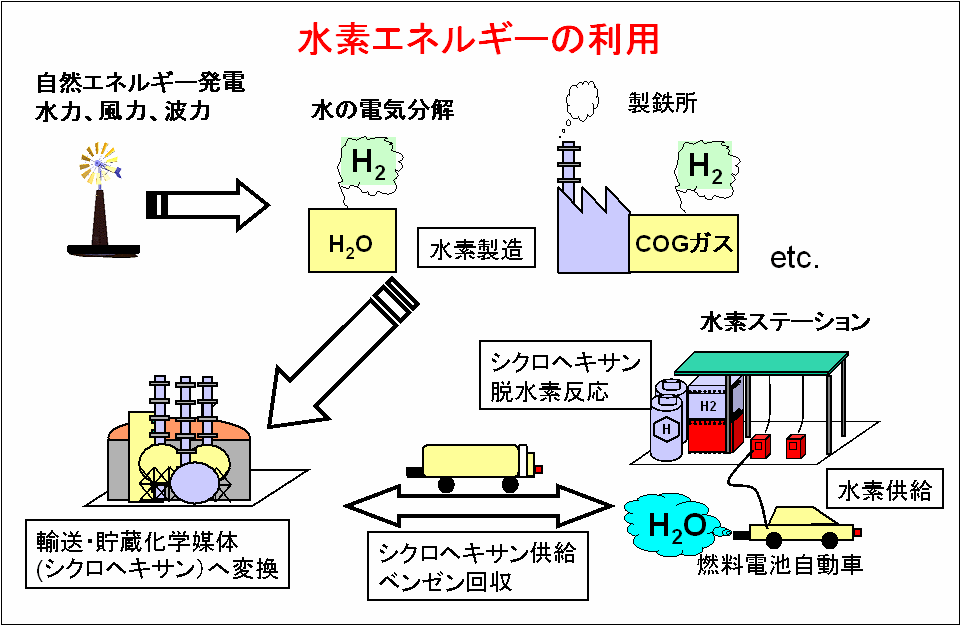
水素は、水を分解することで作ることが可能なのです。
この事は水素を燃料として見た時には大変重要です。何故なら無限と言っても良い水が原料だし、燃やして水に戻るわけですから環境問題になることはありません。
しかし、残念ながらこの水素燃料サイクルは実現していません。それは、エネルギーをあまり使わず水を分解して水素を作ることが大変難しいからです。電気分解で簡単に作れると思うでしょうが、実は電気を作るのに既に多くのエネルギーを無駄にしているのです。今の所、石油を燃やして得られるエネルギーの40%くらいしか電気にすることができていません。しかも、石油は地球上には有限の量しかありませんし、燃やすことで大量の二酸化炭素を廃棄しています。
水力、風力、地熱、太陽光などの自然エネルギーを利用した発電を利用すれば良いということになるのですが、そのまま電気として使えば良いということにもなります。
水素を貯める・運ぶ
膜反応工学研究室について
もし、水素が温泉のように海底や山中から湧き出ているのであれば、それを直接燃やして燃料とすることができますが、残念ながらそのようなことはありません。水素は宇宙で最も多く存在するのですが、他のもの(原子)とくっつき易く単独では存在し難いのです。
石油や石炭は炭素と水素がいくつも結合した炭化水素と呼ばれる物質です。燃やせば二酸化炭素(CO2)と水(H2O)になるとともに熱を発生するので、1次エネルギーと呼ばれます。水素も燃料にはなりますが、ただ直接得ることができず、何らかの方法で作りださなければならないということから2次エネルギーと呼ばれます。
それでは、水素はどのようにして作られるのでしょうか。上述した電気分解の他に、石油や石炭、また廃材木などの植物資源(バイオマス)を利用して水素を作ることができます。これらは、主に炭素(C)と水素(H)からできているので化学式で表せばCnHm(n、mは炭素がn個、水素がm個という意味です)となります。これを原料に水素は、次に示す「水蒸気改質反応」によって作られています。
CnHm + 2nH2O → nCO2 + (2n+m/2) H2
この反応式を見ると、1次エネルギーであるCnHmから水素がm/2個、H2O(水)から2n個作られており、間接的ではあるが水が分解されていることがわかります。
それでは、水素エネルギーを取り出す方法と、その使い方をみていきましょう。
まず、水素と酸素が反応する時の反応式を示します。
2H2 (水素) + O2 (酸素) → 2H2O (水)
発熱量 3.78kcal/水1g
それでは、作った水素をどのように蓄えるのでしょうか?
水素は気体で、液体にするにはマイナス259.2℃に冷やす必要があり簡単ではありません。たとえ液体水素とした場合でも、蒸発しないように保持して置くのもたいへんです。プロパンガスのように容器の中に高圧で充填しておくのが簡単ですが、耐圧性が必要ですからどうしても容器が重たくなってしまいます。
水素を貯蔵したり運んだりするために適した物として、水素を吸収することのできる金属(水素吸蔵合金)や化学物質があります。
水素吸蔵合金: 水素を良く吸うことのできる金属(マグネシウム)を耐圧容器に詰めておき、水素ガスを入れて行くとどんどん吸収します。無限に吸収することはできませんが、詰めた金属が1kgだとすると30g位の水素が吸収されています。
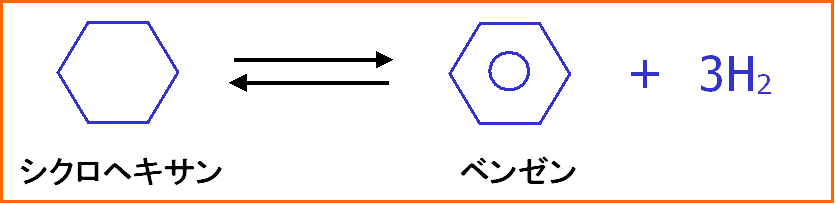
化学物質: 化学反応を利用して水素を貯めることもできます。例えばシクロヘキサン(C6H12)は3個の水素を貯めて放出することができます。1kgのシクロへキサンは70g位の水素を出し入れすることができます。金属と比べると液体なので取り扱いもガソリン並みです。私たちは、こうした化学物質に注目して、それからいかに多く効率良く水素を取り出すにはどうしたら良いか研究しています。
化学反応を利用して水素を吸収・放出できる液体状の化学物質にはシクロヘキサンなどがあります。下の反応式のように、シクロヘキサンは反応によりベンゼンとその3倍量の水素となります。
つまり、水素をを出し入れすることができます。
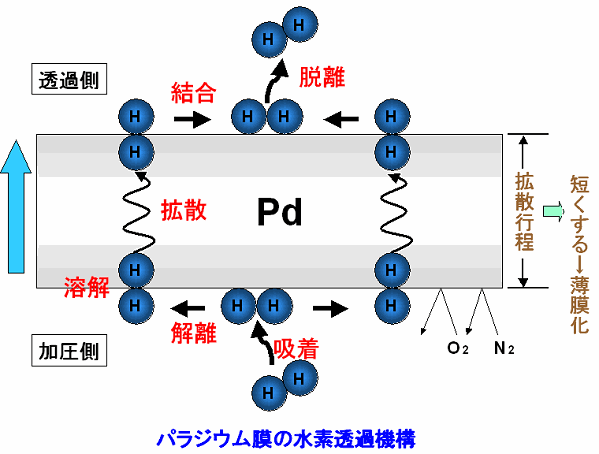
水素を通す不思議な金属 〜パラジウム〜
メンブレンリアクターは、膜を組み込んだ反応器です。
普通、「反応」と「分離」は別の装置で行います。
これに対し、メンブレンリアクターは、反応と分離を同時に行うことができ、
効率良い物質生産が可能となる次世代型の反応装置です。
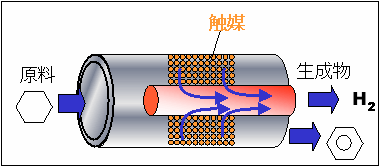
メンブレンリアクターを用いて、シクロヘキサンから水素を取り出してみましょう。
パラジウム膜を組み込んだメンブレンリアクターが下の図です。
反応器に入ったシクロヘキサンは、触媒の働きでベンゼンと水素に分解します。
その後、水素だけがパラジウム膜を通って分離されます。
したがって、ベンゼンと水素が別々の出口から出ていきます。
このように、メンブレンリアクターを用いることで、水素貯蔵物質から純粋な水素のみを効率良く取り出すことができます。
水素は酸素と反応して水になる時、大きな熱を発生します。
その熱を利用すれば、加熱や発電ができます。
先に示した水素の燃焼と逆の反応式を示します。
2H2O (水) → 2H2 (水素) + O2 (酸素)
燃料電池に水素を使うために、取り出した水素は分離しなければなりません。
それでは、水素をどのように分離するのでしょうか?
その答えが「パラジウム膜」です。パラジウムは水素のみを通す特殊な金属です。
下の図に示すように、パラジウム上で水素分子が水素原子となり、金属内を拡散します。
その後、水素原子同士が結合して水素分子となります。
水素以外の物質は、パラジウム内を拡散することができません。
このように、パラジウム膜は「水素のみを通す膜」として働きます。
また、パラジウム膜を薄くすると水素の流れが速くなり、多くの純粋な水素を得ることができます。
水素を取り出す道具 〜メンブレンリアクター〜
水素エネルギー社会の実現に向けて
水素の貯蔵・輸送が可能になると、燃料電池自動車が走るようになるのはもちろん、
燃料電池によって工場・家庭でも燃料電池による効率的な発電が可能となる道が開けます。
水素エネルギー利用は、メンブレンリアクター技術だけでなく、電池の開発など他の技術も必要です。みんなの力を合わせ、これらの技術を互いに補いあわせることで、近い将来、水素エネルギー社会が現実のものとなることでしょう。
私たちの研究室では、ここで紹介した
・パラジウム膜の作成
・メンブレンリアクターを用いた水素製造
に関する研究を進めています。
この他にも、
・メタノールからの水素製造
・ゼオライト膜を用いた分離・反応
・超臨界流体の反応、膜処理への応用
など、より良い社会の構築を目指し、幅広い研究を行っております。
詳しくは、当研究室のホームページをご覧いただき、
興味がございましたらぜひ連絡して頂きたいと存じます。
水素からエネルギーを取り出す